
18新利体育官网入口
Product Center 當前位置:首頁
當前位置:首頁 18新利体育官网入口
18新利体育官网入口 化工原料
化工原料 藥用輔料
藥用輔料 A01藥用環拉酸鈉 預售輔料通知
A01藥用環拉酸鈉 預售輔料通知






藥用環拉酸鈉 預售輔料通知
 產品簡介
產品簡介
| 貨號 | 15555 | 規格 | 25kg |
|---|---|---|---|
| 供貨周期 | 現貨 | 主要用途 | 矯味劑 甜味劑 |
| 應用領域 | 醫療衛生 |
藥用環拉酸鈉 預售輔料通知
藥用環拉酸鈉 預售輔料通知
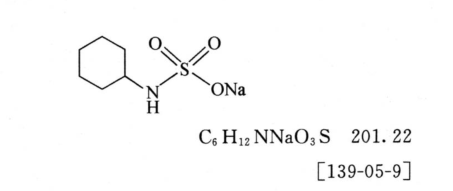 本品為(wei) 環己氨基磺酸鈉鹽。按幹燥品計算,含C6H12NNaO3S不得少於(yu) 98.0%。 【性狀】本品為(wei) 白色結晶性粉末。 本品在水中易溶,在中極微溶,在或中不溶。 【鑒別】(1)取本品約0.1g,加水10ml使溶解,加鹽酸1ml與(yu) 氯化鋇溶液(1→10)1ml,溶液應澄清;再加亞(ya) 硝酸鈉溶液(1→10)1ml,即產(chan) 生白色沉澱。 (2)本品的紅外光吸收圖譜應與(yu) 對照品的圖譜一致(通則0402)。 (3)本品顯鈉鹽的鑒別反應(通則0301)。
本品為(wei) 環己氨基磺酸鈉鹽。按幹燥品計算,含C6H12NNaO3S不得少於(yu) 98.0%。 【性狀】本品為(wei) 白色結晶性粉末。 本品在水中易溶,在中極微溶,在或中不溶。 【鑒別】(1)取本品約0.1g,加水10ml使溶解,加鹽酸1ml與(yu) 氯化鋇溶液(1→10)1ml,溶液應澄清;再加亞(ya) 硝酸鈉溶液(1→10)1ml,即產(chan) 生白色沉澱。 (2)本品的紅外光吸收圖譜應與(yu) 對照品的圖譜一致(通則0402)。 (3)本品顯鈉鹽的鑒別反應(通則0301)。
4、資料按套裝入檔案袋,檔案袋封麵注明:申請分類、注冊(ce) 分類、藥品名稱、本袋所屬第X套第X袋每套共X袋、原件/複印件、申請機構電話。
5、注冊(ce) 申請報送2套完整申請資料(其中至少1套為(wei) 原件)和1套綜述資料(可為(wei) 複印件),各袋均應包含1份申請表。
許可程序
(一)受理:申請人向省局受理部門提出申請,按照本《須知》第四項所列目錄提交申請材料,工作人員按照申報資料要求"對申請材料進行形式審查。申請事項依法不需要取得行政許可的,應當即時告知申請人不受理;申請事項依法不屬於(yu) 本行政機關(guan) 職權範圍的,應當即時作出不予受理的決(jue) 定,並告知申請人向有關(guan) 行政機關(guan) 申請;申請材料存在可以當場更正的錯誤的,應當允許申請人當場更正;申請材料不齊全或者不符合法定形式的,應當當場或者在五日內(nei) 一次告知申請人需要補正的全部內(nei) 容,逾期不告知的,自收到申請材料之日起即為(wei) 受理;申請事項屬於(yu) 本行政機關(guan) 職權範圍,申請材料齊全、符合法定形式,或者申請人按照本行政機關(guan) 的要求提交全部補正申請材料的,應當受理行政許可申請。
需要進行樣品檢驗和藥品標準複核的,藥品檢驗所應當在60日內(nei) 完成。