服務熱線
029-84211816
藥用級環拉酸鈉 YF全部供應信息
藥用級環拉酸鈉 YF全部供應信息
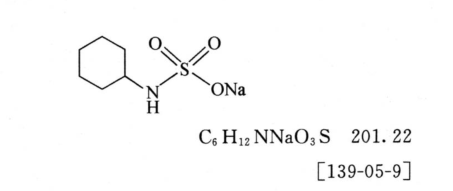 本品為(wei) 環己氨基磺酸鈉鹽。按幹燥品計算,含C6H12NNaO3S不得少於(yu) 98.0%。 【性狀】本品為(wei) 白色結晶性粉末。 本品在水中易溶,在中極微溶,在或中不溶。 【鑒別】(1)取本品約0.1g,加水10ml使溶解,加鹽酸1ml與(yu) 氯化鋇溶液(1→10)1ml,溶液應澄清;再加亞(ya) 硝酸鈉溶液(1→10)1ml,即產(chan) 生白色沉澱。 (2)本品的紅外光吸收圖譜應與(yu) 對照品的圖譜一致(通則0402)。 (3)本品顯鈉鹽的鑒別反應(通則0301)。
本品為(wei) 環己氨基磺酸鈉鹽。按幹燥品計算,含C6H12NNaO3S不得少於(yu) 98.0%。 【性狀】本品為(wei) 白色結晶性粉末。 本品在水中易溶,在中極微溶,在或中不溶。 【鑒別】(1)取本品約0.1g,加水10ml使溶解,加鹽酸1ml與(yu) 氯化鋇溶液(1→10)1ml,溶液應澄清;再加亞(ya) 硝酸鈉溶液(1→10)1ml,即產(chan) 生白色沉澱。 (2)本品的紅外光吸收圖譜應與(yu) 對照品的圖譜一致(通則0402)。 (3)本品顯鈉鹽的鑒別反應(通則0301)。
4、資料按套裝入檔案袋,檔案袋封麵注明:申請分類、注冊(ce) 分類、藥品名稱、本袋所屬第X套第X袋每套共X袋、原件/複印件、申請機構電話。
5、注冊(ce) 申請報送2套完整申請資料(其中至少1套為(wei) 原件)和1套綜述資料(可為(wei) 複印件),各袋均應包含1份申請表。
許可程序
(三)藥品注冊(ce) 檢驗:
藥品注冊(ce) 檢驗與(yu) 技術審評並列進行。
藥品檢驗所在接到注冊(ce) 檢驗通知和樣品後,應當在30日內(nei) 完成檢驗,出具藥品注冊(ce) 檢驗報告,並報送國家18新利体育客户端藥品監督管理局,同時抄送通知其檢驗的省級18新利体育客户端藥品監督管理部門和申請人。
需要進行樣品檢驗和藥品標準複核的,藥品檢驗所應當在60日內(nei) 完成。
(四)送達:
省局作出行政許可決(jue) 定後,5日內(nei) 在省局網站上發布,若申請人10日內(nei) 未領取批件,電話通知申請人。
自受理之日起,60日內(nei) 完成現場核查、抽取樣品、通知藥品檢驗所進行注冊(ce) 檢驗、將審查意見和核查報告連同申請人的申報資料一並報送國家18新利体育客户端藥品監督管理局等工作,同時將審查意見通知申請人。該時限不包括申請人補正資料所需的時間。
| 如果你對A018藥用級環拉酸鈉 YF全部供應信息感興趣,想了解更詳細的產品信息,填寫下表直接與廠家聯係: |